Limitées à des applications spatiales au siècle dernier, les piles à combustible envahissent désormais tous les secteurs d’activité : les transports avec les piles embarquées, les entreprises et les logements avec les piles stationnaires, la vie quotidienne avec les piles miniaturisées. mais qu’est-ce qu’une pile à combustible ? Réponse de deux éminents spécialistes.
Le concept de pile à combustible est connu depuis le début du 19e siècle, mais c’est au cours de la deuxième moitié du 20e siècle que les progrès de la science et de la technologie ont considérablement accru ses performances et lui ont ouvert de nouvelles perspectives industrielles.
1. La pile à combustible, un générateur électrochimique ouvert
Nous utilisons quotidiennement des générateurs fermés (alternateurs, moteurs) ce que ne sont précisément pas les piles à combustible qui sont des générateurs ouverts.
1.1. Qu’est-ce qu’un générateur électrochimique ?
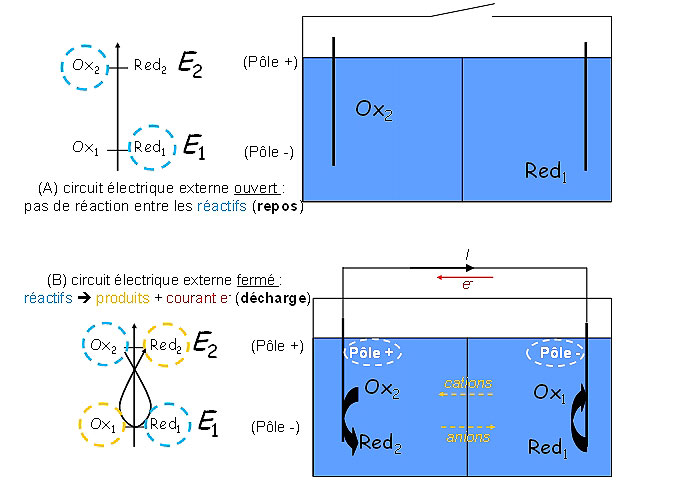
La pile à combustible est un générateur électrochimique qui convertit l’énergie stockée dans les liaisons chimiques de composés (appelés oxydant : capable de recevoir des électrons en se réduisant, et réducteur : capable de perdre des électrons en s’oxydant) en énergie électrique et en chaleur. Cette transformation de la matière en énergie électrique n’est possible que pour des réactions spontanées, c’est-à-dire des réactions pouvant libérer de l’énergie au sens de la thermodynamique ; en d’autres termes, si les liaisons chimiques des réactifs contiennent plus d’énergie que celles des produits, alors la transformation des réactifs en produit est irrémédiable. La vitesse à laquelle s’effectue cette transformation est néanmoins variable et dépend de la barrière d’activation de la réaction considérée : elle peut être infiniment rapide (ex. explosion), ou lente (ex. corrosion du fer à température ambiante) selon les conditions expérimentales (concentrations, température, pression, etc.). Cette transformation, si elle s’effectue par réaction directe de l’oxydant sur le réducteur, libère l’énergie sous forme de chaleur, qui peut être ensuite convertie sous forme mécanique (c’est le cas des machines thermiques) ou électrique ; dans ce cas, le rendement de la conversion énergétique est limitée par le cycle de Carnot [1] (cf. 3.1. Les avantages thermodynamiques des piles à combustible).
L’intérêt des générateurs électrochimiques est précisément d’éviter le contact direct de l’oxydant et du réducteur : les séparer par un milieu permettant la conduction de charges ioniques mais incompatible avec la conduction électronique (l’électrolyte) rend possible la valorisation d’énergie électrique à la demande. En effet, les électrons issus de la réaction d’oxydation et utilisés par celle de réduction peuvent alors passer par un circuit électrique extérieur au générateur. Ce circuit est maintenu en position ouverte (Figure 1(A)) ou fermée (Figure 1(B)) par l’utilisateur, qui décide donc du passage des charges électriques ou non. La conversion directe de l’énergie chimique en énergie électrique est thermodynamiquement plus efficace que la voie thermique (type Carnot), mais dépend de la cinétique des processus mis en jeu (cf. plus bas) [1, 2]. Elle repose sur des réactions électrochimiques contrôlées, ayant lieu aux interfaces entre chacune des deux électrodes (celle contenant l’oxydant et l’autre contenant le réducteur) et l’électrolyte les séparant physiquement. A ce titre, les générateurs électrochimiques sont des réacteurs (électro)chimiques hétérogènes. Leurs performances dépendent de la nature des matériaux utilisés, mais également de leur mise en forme ; aux processus nécessaires de transfert de charge (i.e. les réactions électrochimiques qui permettent la génération de courant électrique) sont associés des processus de transport de matière non moins nécessaires, car seule la matière active présente aux interfaces (électrode | électrolyte) pourra être valorisée. On comprend dès lors que le dimensionnement et le fonctionnement des générateurs électrochimique n’est pas trivial ; il sera mis en lumière dans la section 4. Technologie des piles à combustible à membrane échangeuse de protons (PEMFC).
1.2. La pile à combustible : un générateur électrochimique ouvert
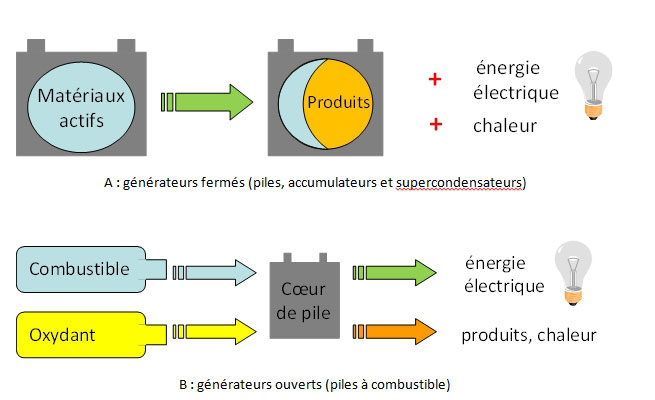
Parmi les nombreux types de générateurs électrochimiques, certains contiennent la matière active (source d’énergie) et sont à ce titre des systèmes de stockage et de conversion de l’énergie. C’est le cas des piles et accumulateurs [2, 3], également dénommés générateurs électrochimiques fermés (Figure 2(A)). Les supercondensateurs rentrent aussi dans cette famille de générateurs, bien qu’à proprement parler, ils ne mettent pas en jeu de réactions électrochimiques [4]. Lorsque les réactifs sont consommés, ces systèmes doivent être recyclés (piles) ou rechargés (accumulateurs). Ils sont donc intrinsèquement limités en densité d’énergie : à titre d’exemple, les accumulateurs au lithium, les plus performants d’entre eux, n’exhibent pas des densités pratiques d’énergie supérieures à ca. 200 Wh kg-1 (rapporté à la masse de système [5]).
La technologie de générateurs électrochimiques ouverts (au premier rang desquels les piles à combustible : PAC, Figure 2(B)) permet de palier à ces insuffisances de densité énergétique. Dans ce cas, le générateur est approvisionné durant son utilisation par le biais de réservoirs pour le combustible (réducteur) et le comburant (oxydant), dont le dimensionnement adéquat ou la fréquence de remplissage permet d’adapter l’autonomie du système ; une décharge continue (stationnaire) est même possible, contrairement au cas des générateurs fermés. Ces propriétés confèrent aux PAC des densités énergétiques bien supérieures aux générateurs électrochimiques fermés.
Pour rendre possible son approvisionnement, le combustible doit être gazeux (typiquement : dihydrogène, H2) ou liquide (ex. alcools légers) ou encore en solution (par exemple NaBH4 dissous dans l’eau à pH basique). Pour l’oxydant, il en est de même (ex. O2 gazeux ou peroxyde d’hydrogène liquide) ; en outre, l’oxydant est souvent le dioxygène directement prélevé dans l’air ambiant et n’est donc pas à stocker.
2. Les différents types de piles à combustible
Découvertes dans leur principe dès 1802 par Sir Davy [6], les piles à combustible sont restées des curiosités de laboratoire entre leur première mise en pratique en laboratoire, par Sir Grove en 1839 [7] et les travaux de Bacon dans les années 1940-50, qui débouchèrent sur le premier système de puissance (6 kW) [8]. Néanmoins, les travaux de ce dernier inspirèrent les ingénieurs de la NASA (National Aeronautics and Space Administration, i.e. l’administration nationale de l’aéronautique et de l’espace des États-Unis d’Amérique), qui firent des piles à combustible les générateurs électriques de toutes leurs missions Gemini et Apollo, puis de celles des navettes (missions Shuttle) jusqu’aux années 2000 [8]. Ces applications, les premières pour des systèmes considérés comme trop coûteux et, à l’époque, non concurrentiels en termes de densité de puissance, ont montré que les PAC étaient des générateurs très pertinents en termes de densité d’énergie et de rendement de conversion de l’énergie chimique en énergie électrique.
2.1. Les avantages thermodynamiques des piles à combustible
La densité d’énergie supérieure des PAC sur les générateurs électrochimiques fermés provient à la fois de la dissociation spatiale des fonctions « stockage » (réservoir) et « conversion » (cœur de pile), mais aussi du fait que l’oxydant est en général prélevé dans l’air. Les PAC sont aussi intéressantes par rapport à d’autres types de générateurs ouverts que sont les machines thermiques. En effet, le rendement théorique maximal d’une machine thermique, donné par le théorème de Carnot [1] :
$${epsilon^{Thermique}_{rev}= frac{W_{rev}}{-Delta H}=1-frac{T_2}{T_1}}$$
est en général inférieur à 30 % pour les moteurs à combustion interne (jusqu’à ca. 40 % pour une turbine à gaz), car la température maximale de stabilité des matériaux du moteur n’est pas extensible à volonté (avec $${epsilon^{Thermique}_{rev}}$$ le rendement théorique (réversible) de la machine thermique, Wrev le travail mécanique réversible, ΔH l’enthalpie de la réaction et $${frac{T_2}{T_1}}$$ le rapport des températures absolues de fonctionnement de la machine).
Une pile à combustible utilisant le même couple combustible / oxydant dans des conditions réversibles, à température et pression constante, présente un rendement thermodynamique : $${epsilon^{Pile}_{rev}= frac{W_{rev}}{-Delta H}=frac{nFDelta E_{eq}}{Delta H} = frac{Delta G}{Delta H}=1-frac{T Delta S}{Delta H}}$$ (avec $${epsilon^{Pile}_{rev}}$$ le rendement théorique (réversible) de la PAC, We le travail électrique réversible, ΔG, ΔS, ΔEeq l’enthalpie libre, l’entropie et la force électromotrice de la pile (différence des potentiels thermodynamiques des deux demi-réactions se produisant aux électrodes), n le nombre d’électrons mis en jeu et F la constante de Faraday. Par exemple, $${epsilon^{Pile}_{rev}}$$ vaut 83 % pour le combustible H2 (à 298 K).
En pratique, le rendement d’une PAC dépend du courant qu’elle délivre, du fait de limitations cinétiques. La première concerne le rendement faradique Qf i.e. la propension qu’a la réaction d’utiliser efficacement tout le combustible ; contrairement au cas des générateurs fermés, où Qf est en pratique très inférieur à l’unité, le caractère gazeux ou liquide du combustible fait qu’on s’approche vraiment de Qf = 100 %, au besoin, au moyen d’une recirculation du combustible. La seconde limitation provient de la cinétique du transfert de charges et du transport de matière jusqu’à l’interface ; elle sera détaillée dans la section 4.3. Les performances et la durabilité des PEMFC.
2.2. Implications sur la température de fonctionnement, les matériaux constituants et le choix du combustible
Depuis leur découverte, de nombreux systèmes de piles à combustible ont été étudiés en laboratoire, développés au niveau (pré)industriel et testés sur site. Si tous permettent de convertir un combustible en énergie électrique, moyennant une réaction électrochimique avec un oxydant, cette conversion est possible à des températures et sur des matériaux (les électrocatalyseurs et l’électrolyte) variables. Cela permet la distinction de plusieurs familles de piles à combustible, en général grâce à leur température de fonctionnement, la nature de leurs matériaux de cœur ainsi que celle des réactifs qui peuvent raisonnablement être mis en œuvre en leur sein. Le Tableau 1 récapitule les principales familles de PAC.
Tableau 1 : les différentes familles de piles à combustibles.
|
Dénomination
|
Electrolyte
|
Catalyseur types
|
Température
d’opération
|
Niveau de développement
|
|
|
Anode
|
Cathode
|
||||
|
AFC
|
KOH
|
Pt ou métaux non nobles
|
Pt ou métaux non nobles
|
< 353 K
|
Production de niche
|
|
AEMFC
|
Polymère alcalin (OH–)
|
Pt ou métaux non nobles
|
Pt ou métaux non nobles
|
< 353 K
|
Recherche
|
|
PEMFC
|
Polymère acide (H+)
|
Pt et alliages
|
Pt et alliages
|
< 373 K
|
Commerciales
|
|
PAFC
|
H3PO4
|
Pt
|
Pt
|
473 K
|
Production arrêtée
|
|
MCFC
|
Li2CO3/ K2CO3
|
Ni
|
Ni lithié
|
923 K
|
Prototypes
|
|
SOFC
|
ZrO2-Y2O3
|
Ni
|
Pérovskite (ABO3)
|
973 – 1273 K
|
Prototypes
|
AFC = Alkaline Fuel Cell (PAC alcaline);
EAMFC = Anion Exchange Membrane Fuel Cell (PAC à membrane anionique) ;
PEMFC = Proton Exchange Membrane Fuel Cell (PAC à membrane échangeuse de protons) ;
PAFC = Phosphoric Acid Fuel Cell (PAC à acide phosphorique) ;
MCFC = Molten carbonate Fuel Cell (PAC à carbonates fondus) ;
SOFC = Solid Oxide Fuel Cell (PAC à oxydes solides)
A priori, toutes ces PAC sont susceptibles de fonctionner avec des combustibles complexes, le gaz de reformat (mélange dihydrogène et monoxyde de carbone : H2 + CO) ou alors le dihydrogène, solution la plus aisée à mettre en œuvre, bien que le stockage de H2 demeure un problème réel [lien vers article stockage H2 ?]. Néanmoins, l’oxydation directe de combustibles complexes (type méthane : CH4, ou alcools légers) demeure difficile, même à température élevée (ex. problème de formation de coke sur les anodes de SOFC valorisant le méthane [1] ; lenteur des réactions d’oxydation de petites molécules organiques en PEMFC : DMFC [1]). Finalement, l’espoir de pouvoir valoriser des combustibles complexes, à la fois denses en énergie et plus aisés à stocker que H2 viendra peut-être des AEMFC, qui tireraient ainsi parti de la plus grande cinétique de telles réactions comme de la stabilité de composés intéressants (ex. NaBH4 [9] ; N2H4,H2O [10]) en milieux alcalins [8, 11]. Au niveau de l’oxydant, mis à part quelques applications particulières (ex. sous-marins ou engins spatiaux, qui peuvent être alimentés en solution aqueuse de H2O2 ou en O2 bouteille / liquide, respectivement), c’est le dioxygène de l’air qu’il est plus pertinent d’utiliser, car il est abondant, gratuit et permet de s’affranchir de tout dispositif de stockage, simplifiant en cela le système PAC.
Parmi ces familles, on distingue des PAC dont l’avancement technologique est mâture : ainsi les AFC ont été utilisées avec succès dans la conquête spatiale et plusieurs centaines de PAFC ont permis de produire électricité et chaleur (en cogénération) en Europe, aux États-Unis et au Japon. Malgré ces succès, ces technologies ne sont plus d’actualité car elles utilisent des métaux nobles (Pt) comme catalyseurs en quantité trop importante et sont inadaptées à la production de masse [8, 11].
D’autres au contraires sont alléchantes en termes de performances, mais difficiles à mettre en œuvre en pratique, car leur température de fonctionnement élevée conduit à une instabilité importante des matériaux et assemblages ; les MCFC et SOFC restent donc à ce jour au stade de la recherche technologique [8, 11].
De ce fait, à ce jour, seules les PAC fonctionnant avec une membrane électrolyte à une température de fonctionnement proche de l’ambiante restent envisageables pour un déploiement large à court terme. Pour ce qui est des AEMFC, leur intérêt réside dans la possibilité d’emploi de matériaux d’électrocatalyseurs plus abondants et moins onéreux que les PEMFC et la possibilité d’oxyder directement un combustible complexe (ce qui est plus difficile pour une PEMFC), mais il reste encore beaucoup de travail de recherche et développement à accomplir avant de voir ces systèmes s’imposer. Finalement, seules les PEMFC sont envisagées sérieusement par les industriels et commencent à être commercialisées pour alimenter en énergie électrique des chariots élévateurs [12, 13], certains sites isolés [14], ou des habitations (la chaleur produite par la PEMFC étant utilisée pour le chauffage) [15]. C’est sur ces systèmes que la suite de cet article se fondera, pour détailler le fonctionnement ainsi que les avantages et inconvénients des PAC.
3. Technologie des piles à combustible à membrane échangeuse de protons (PEMFC)
Parmi les divers systèmes de piles à combustible, les PEMFC (proton exchange membrane fuel cell) présentent un intérêt particulier.
3.1. Le système PEMFC et ses annexes
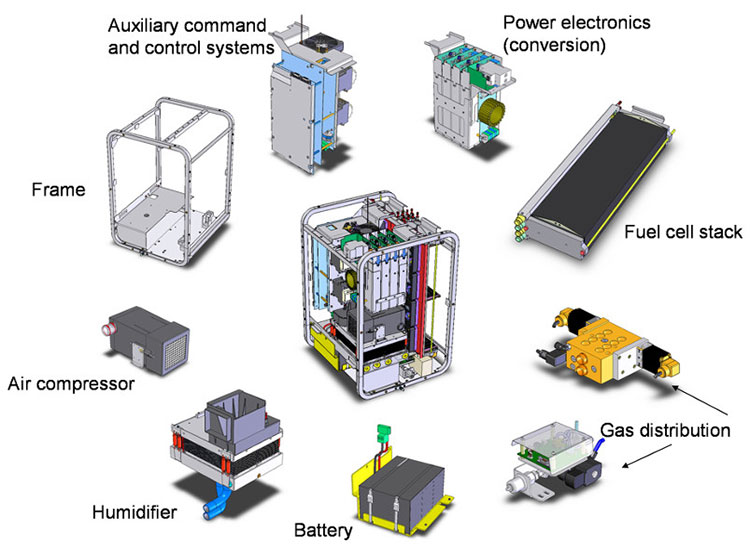
A l’instar des autres piles à combustible, une PEMFC est un générateur électrochimique ouvert. A ce titre, une PEMFC ne peut fonctionner seule ; elle doit être intégrée au sein d’un système, comportant un certain nombre de dispositifs appelés « annexes ». Le Figure 3 donne une vue éclatée d’un système PEMFC tel qu’il est produit par Axane ; il contient un cadre sur lequel l’empilement de cellules élémentaires (fuel cell stack) et les annexes seront fixés. L’oxydant (O2) étant puisé dans l’air, le système PEMFC doit pouvoir le filtrer et le comprimer (air compressor), l’humidifier (humidifier) et le distribuer (gas distribution). La puissance électrique générée par la PEMFC doit être convertie selon les besoins de l’utilisateur (power electronics, conversion), une batterie d’accumulateur tampon étant adjointe à la PEMFC pour alimenter les annexes au démarrage et extinction du système, cette batterie étant rechargée et maintenue en charge par la PEMFC lorsque cette dernière fonctionne. L’ensemble de ces annexes est géré par un système de contrôle-commande (auxiliary command and control system). Bien entendu, à ces dispositifs, il est nécessaire d’adjoindre le réservoir de combustible, dont la taille ou la fréquence de remplissage déterminera l’autonomie du système PEMFC. Le cœur de ce système pile est le module (stack), lui-même composé d’assemblages membrane-électrodes, qui sont connectés entre eux par les plaques bipolaires (cf. 4.2. De l’assemblage membrane-électrodes au stack : le cœur de la PEMFC).
3.2. De l’assemblage membrane-électrodes au stack : le cœur de la PEMFC
Les réactions d’électrode (électrooxydation du dihydrogène – réaction en bleu sur la Figure 4 ; électroréduction du dioxygène – en bleu sur la Figure 4) se produisent sur des électrocatalyseurs à base de Pt. Au final, une cellule élémentaire de PEMFC conduit à la formation d’eau : H2 + ½ O2 → H2O, ce qui advient à une tension théorique de cellule de 1,23 V dans les conditions standard. En pratique, des limitations cinétiques conduisent à une diminution non négligeable de la tension d’une cellule (cf. 4.3. Les performances et la durabilité des PEMFC) et rend nécessaire l’assemblage de plusieurs cellules élémentaires en série (au moyen de plaques bipolaires) afin d’obtenir une tension valorisable en termes de génie électrique.
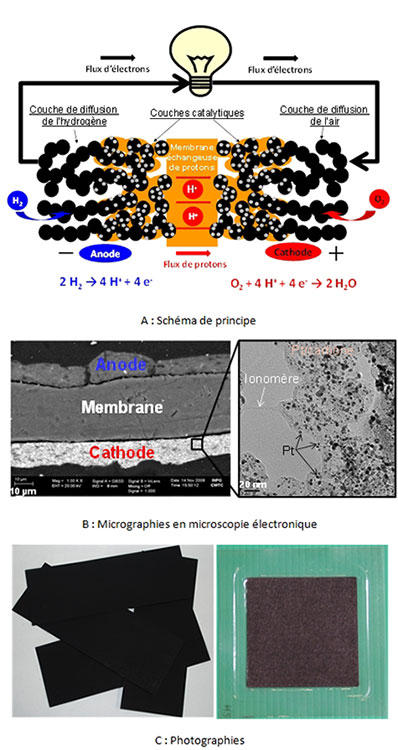
Les électrocatalyseurs état de l’art sont à base de platine ou de ses alliages avec des métaux de transition (Co, Ni, Cu). Compte-tenu de leur coût intrinsèque élevé et de la faible abondance de métal, ils sont dispersés sous forme de nanoparticules sur un substrat conducteur de grande aire développée (en général un noir de carbone). Cela permet (i) d’augmenter le rapport surface (lieu de la réaction) sur volume (coût en métal), (ii) de distribuer le volume réactionnel sur un volume (les couches catalytiques font en général environ 10 µm d’épaisseur), et d’améliorer la vitesse de conversion des réactifs par cm2 d’électrode, (iii) tout en distribuant le ionomère (polymère de la membrane échangeuse de protons, permettant l’accès des protons au sein des couches catalytiques) et de maintenir une porosité suffisante pour l’accès des réactifs gazeux et l’évacuation des produits de réaction (eau issue de la réaction cathodique, azote issu de l’air). Cette structure complexe repose sur l’existence de chemins percolants (i) pour les électrons depuis les collecteurs de courant (plaques bipolaires), via les couches de diffusion et jusqu’aux couches actives, (ii) pour les ions (protons) de la couche catalytique d’anode à travers la membrane et jusqu’à la couche catalytique de cathode et enfin (iii) de porosité pour l’accès des réactifs et l’évacuation des produits.
La membrane assure quant à elle des propriétés multiples : barrière aux réactifs (pour éviter leur mélange et donc toute réaction directe qui ne permettrait pas la génération de courant électrique) et aux électrons (pour éviter tout court-circuit interne, elle doit permettre le passage des charges (protons) et ainsi un flux continu de courant sur l’ensemble (PAC + circuit extérieur)). Les couches de diffusion doivent approvisionner les couches actives en réactif tout en éliminant les produits de réaction (notamment l’eau liquide) ; elles doivent donc être hydrophobes et poreuses. Enfin, les plaques bipolaires doivent interconnecter les cellules élémentaires adjacentes, et présenter à ce titre une très bonne conductivité électrique (dans leur volume et en termes de résistance de contact avec les matériaux de couche de diffusion), être résistante mécaniquement et (électro)chimiquement à l’environnement agressif d’une PEFMC. Elles doivent aussi approvisionner de façon la plus homogène possible les réactifs sur toute la surface géométrique des couches de diffusion, ce qui est en général effectué au moyen de canaux millimétriques gravés/usinés/moulés/formés à leur surface.
De son cœur vers l’extérieur, l’AME est donc un empilement de couches nanostructurées aux propriétés bien spécifiques d’électrocatalyse, de transport de matière et de charges. Ainsi, les couches catalytiques assurent ces trois fonctions ; les couches de diffusion assurent le transport de matière (réactifs et produits) et la conduction électronique depuis/jusqu’aux plaques bipolaires, ces dernières assurant l’interconnexion d’une cellule élémentaire (cœur de pile) à l’autre.
3.3. Les performances et la durabilité des PEMFC
Les performances d’un système PEFMC dépendent de celles du stack, qui elles-mêmes dépendent de celles des cellules élémentaires, mais aussi de celles des annexes. Par extension, les performances d’une cellule élémentaire de PEMFC sont fixées par les matériaux la composant (membrane, électrocatalyseurs), mais aussi de leur architecture et assemblage (couches catalytiques, couches de diffusion, assemblage membrane-électrodes, etc.). Constituer un système PEMFC performant est donc extrêmement complexe et repose sur un travail poussé entre spécialistes des matériaux (polymères, carbonés, électrocatalyseurs), des assemblages (rhéologie des encres, couches minces, etc.), du génie mécanique et du génie des procédés (gestion du transport de matière, de la stabilité mécanique, de la thermique, etc.), ce qui explique la très longue période d’induction entre la découverte des PAC (au milieu du 19ème siècle et leur déploiement commercial (qui s’initie tout juste pour les PEMFC depuis le début du 21ème siècle).
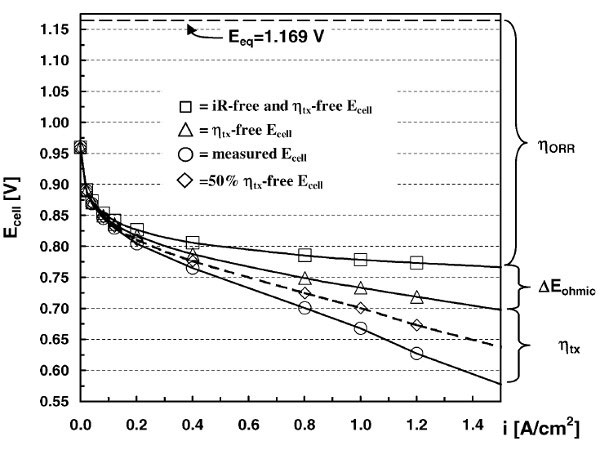
Concrètement, les performances apparentes d’une monocellule de PEMFC reflètent cette complexité. Ainsi, une courbe de polarisation de monocellule (Figure 1), i.e. le potentiel de la cellule à une densité de courant ( o , cette densité étant exprimée en A cm-2 géométrique d’électrode) s’éloigne sensiblement de la valeur prévue par la thermodynamique (Eeq, – – – – -). Les limitations cinétiques sont responsables de cet écart, qui conduit à diminuer le rendement pratique de conversion de l’énergie chimique en énergie électrique, comme déjà mentionné en section 3.1. Les avantages thermodynamiques des piles à combustible.
Figure 5 : Le potentiel de cellule à un courant donné ( o ) diffère du potentiel thermodynamique (Eeq, – – – -) à cause de l’existence de limitations cinétiques, qui se manifestent par des surtensions (pertes de tension) due à la faible cinétique de la réduction du dioxygène à la cathode (ηORR, * ), aux pertes ohmiques dans la membrane, dans les électrodes et aux interfaces (rEohmic , r ) et aux pertes liées à l’insuffisance de la vitesse de transport de matière (ηtx, –¸–).
Elles se manifestent par des surtension (pertes de tension) qui ont plusieurs origines : la faible cinétique de la réduction du dioxygène à la cathode (ηORR, * ), les pertes ohmiques dans la membrane, les électrodes et aux interfaces (rEohmic , r ) et les pertes liées à l’insuffisance de la vitesse de transport de matière (ηtx, —¸—). Chacune de ces pertes peut être adressée par un travail sur les matériaux et les assemblages de cœur de PEMFC [18, 19].
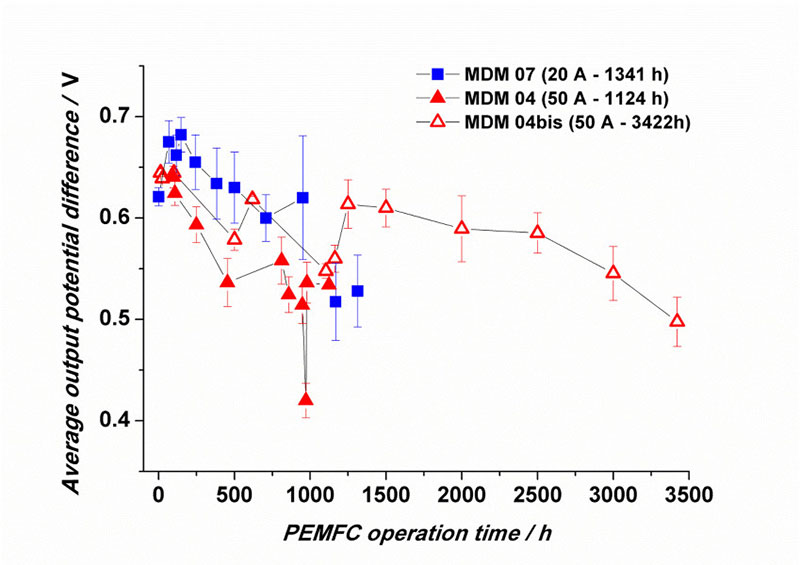
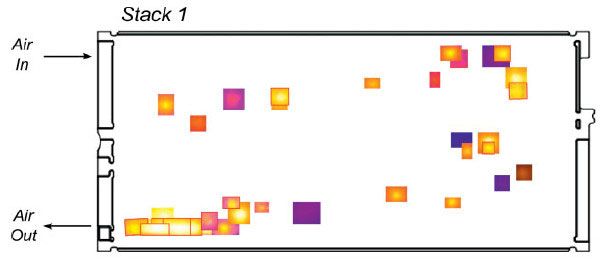
En outre, les performances des PEMFC diminuent au cours du temps (voire l’exemple de la Figure 6), car les matériaux et assemblages se dégradent, ce qui conduit in fine à la baisse des performances électriques des cellules, voire même à la fin de vie du système, souvent parce que la membrane est percée (Figure 7). Les mécanismes de dégradation des matériaux de PEMFC sont extrêmement complexes et abondamment étudiés dans la littérature [16, 20-30].
3.4. Quelques exemples de réalisations industrielles
L’activité PEMFC est intense à l’échelle de la planète, mais aussi en France et en particulier dans la région grenobloise. Ainsi, trois acteurs industriels des PEMFC sont localisés dans le bassin grenoblois.
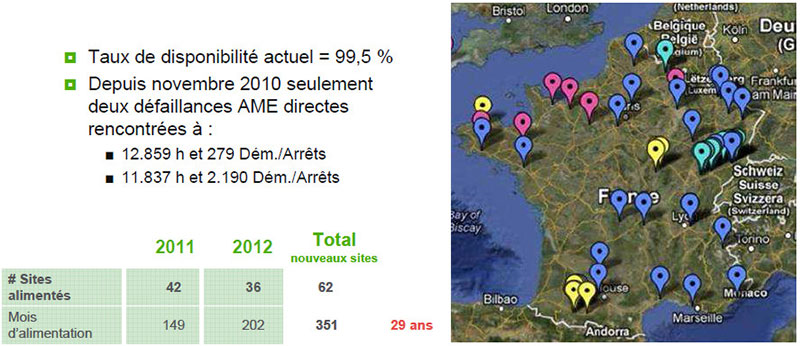
Par ordre chronologique de début d’activité, Axane, filiale d’Air Liquide (http://www.airliquideadvancedbusiness.com/fr/qui-sommes-nous/axane.html), est présent depuis environ 12 ans sur le domaine des systèmes PEMFC de 0,5 à 5 kW pour les applications stationnaire (secours, groupe électrogène, alimentation stabilisée). Ses systèmes ont notamment été déployés pour l’alimentation de relais de télécommunications (Figure 8 : déploiements de systèmes PEMFC d’Axane en 2012 et performances atteintes sur site (durabilité, disponibilité, etc.). D’après [14] avec la permission de l’auteur.).
A une échelle plus restreinte en termes de puissance des systèmes produits, la société Paxitech (http://www.paxitech.fr/) commercialise des composants de PEMFC (assemblages membranes électrodes, cellules unitaires) ainsi que de petits systèmes pour applications nomades qui fonctionnent en respiration, i.e. sans avoir besoin des annexes mentionnées en 4.1. Le système PEMFC et ses annexes.
Enfin, Symbio FCell (http://www.symbiofcell.com/), émanation du CEA, conçoit des systèmes de prolongateur d’énergie (en anglais range extender) pour véhicules électriques. Ces trois exemples montrent que les PEMFC sont désormais à même de répondre aux attentes de consommateurs et que ces systèmes sont en train de devenir une réalité technologique et commerciale.
4. Conclusions
Les piles à combustible sont des générateurs ouverts qui complètent bien l’offre des générateurs fermés dont nous sommes tous utilisateurs. Leur caractère ouvert leur confère une densité d’énergie plus élevé que leurs concurrents, mais aussi un degré de complexité indéniablement plus marqué. Parmi les différentes familles de PAC, les PEMFC sont de loin la technologie la plus mature. Après des décennies de recherche et d’améliorations technologiques, ces systèmes ont atteint des performances initiales satisfaisantes, une durabilité accrue et une fiabilité qui s’améliore constamment, qui les rendent désormais compatibles avec un déploiement industriel (Lire : Des véhicules hybrides à hydrogène et Stockage des énergies renouvelables sous forme d’hydrogène pour sites isolés).
5. Remerciements
Nous remercions l’ANR et OSEO pour leur financement de nos recherches. Les sociétés Axane et Paxitech, ainsi que nos collègues des équipes EI et LMOPS du LEPMI, et ceux du LEMTA ont également grandement contribué aux échanges scientifiques de qualité qui nous ont amené jusqu’ici ; pour cela, nous les remercions.
A titre personnel, MC remercie chaleureusement S. Rosini et M. Billy pour leurs idées d’illustrations, ainsi que l’IUF pour son soutien.
Notes et références
[1] M. Cassir, P. Stevens, F. Novel-Cattin, A. Hammou, C. Lamy, Piles à combustible, in: Techniques de l’ingénieur Accumulateurs d’énergie, vol. base documentaire : TIB243DUO, Editions T.I., 2000, pp. d3340.
[2] C. Sarrazin, Piles électriques Présentation générale, in: Techniques de l’ingénieur Accumulateurs d’énergie, vol. base documentaire : TIB243DUO, Editions T.I., 2001, pp. d3320.
[3] A. Jean, R. Jack, Accumulateurs Considérations théoriques, in: Techniques de l’ingénieur Accumulateurs d’énergie, vol. base documentaire : TIB243DUO, Editions T.I., 2004, pp. d3351.
[4] J.-C. Lassègues, Supercondensateurs, in: Techniques de l’ingénieur Accumulateurs d’énergie, vol. base documentaire : TIB243DUO, Editions T.I., 2001, pp. d3334.
[5] A. Jean, R. Jack, Accumulateurs Accumulateurs au lithium, in: Techniques de l’ingénieur Accumulateurs d’énergie, vol. base documentaire : TIB243DUO, Editions T.I., 2005, pp. d3354.
[6] H. Davy, Nicholson’s Journal of Natural Philosophy, 1 (1802) 144.
[7] W.R. Grove, On Voltaic series and the combination of gases by platinum, Philosophical Magazine, 14 (1839) 127.
[8] W. Vielstich, A. Lamm, H.A. Gasteiger, Handbook of Fuel Cells, Wiley, Chichester, 2003.
[9] M. Chatenet, B.M. Concha, G. Parrour, J.-P. Diard, F.H.B. Lima, E.A. Ticianelli, Potential and limitation of the direct borohydride fuel cell. special emphasis on the borohydride oxidation reaction (bor) mechanism and kinetics on gold electrocatalysts, in: U.B. Demirci, P. Miele (Eds.) Boron Hydrides High Potential Hydrogen Storage Material, Nova Science Publishers, Inc., New York, 2010.
[10] K. Asazawa, K. Yamada, H. Tanaka, A. Oka, M. Taniguchi, T. Kobayashi, A platinum-free zero-carbon-emission easy fuelling direct hydrazine fuel cell for vehicles, Angewandte Chemie, International Edition, 46 (2007) 8024.
[11] H.A. Gasteiger, W. Vielstich, H. Yokokawa, Handbook of Fuel Cells, John Wiley & Sons Ltd, Chichester, 2009.
[12] Clean-Energy-Now, 2014-02-10
[13] V.P. McConnell, Fuel cells in forklifts extend commercial reach, Fuel Cells Bulletin, 2010 (2010) 12.
[14] E. Claude, La pile à combustible : une réalité industrielle, in: CNRS (Ed.) GDR PACS, 28 Novembre, 2012.
[15] K. Maeda, M. Suzuki, H. Aki, R&D and deployment of residential fuel cell cogeneration systems in Japan, in: Power and Energy Society General Meeting – Conversion and Delivery of Electrical Energy in the 21st Century IEEE Xplore, Pittsburg, USA, 2008.
[16] L. Dubau, L. Castanheira, F. Maillard, M. Chatenet, O. Lottin, G. Maranzana, J. Dillet, A. Lamibrac, J.-C. Perrin, E. Moukheiber, A. ElKaddouri, G. De Moor, C. Bas, L. Flandin, N. Caqué, A review of PEM fuel cell durability: materials degradation, local heterogeneities of aging and possible mitigation strategies, Wiley Interdisciplinary Reviews: Energy and Environment, 3 (2014) in press.
[17] http://www.paxitech.com, June 2nd 2014
[18] H.A. Gasteiger, S.S. Kocha, B. Sompalli, F.T. Wagner, Activity benchmarks and requirements for Pt, Pt-alloy, and non-Pt oxygen reduction catalysts for PEMFCs, Appl. Catal. B: Environmental, 56 (2005) 9.
[19] M. Chatenet, L. Dubau, N. Job, F. Maillard, The (electro)catalyst | membrane interface in the Proton Exchange Membrane Fuel Cell: similarities and differences with non-electrochemical Catalytic Membrane Reactors, Catal. Today, 156 (2010) 76.
[20] E. Guilminot, A. Corcella, M. Chatenet, F. Maillard, F. Charlot, G. Berthome, C. Iojoiu, J.-Y. Sanchez, E. Rossinot, E. Claude, Membrane and Active Layer Degradation upon PEMFC Steady-State Operation, J. Electrochem. Soc., 154 (2007) B1106.
[21] C. Iojoiu, E. Guilminot, F. Maillard, M. Chatenet, J.-Y. Sanchez, E. Claude, E. Rossinot, Membrane and Active Layer Degradation Following PEMFC Steady-State Operation, J. Electrochem. Soc., 154 (2007) B1115.
[22] C. Bas, L. Reymond, A.S. Danerol, N.D. Alberola, E. Rossinot, L. Flandin, Key Counter Ion Parameters Governing Polluted Nafion Membrane Properties, J. Polym. Sci., Part B: Polym. Phys., 47 (2009) 1381.
[23] C. Bas, L. Flandin, A.S. Danero, E. Claude, E. Rossinot, N.D. Alberola, Changes in the Chemical Structure and Properties of a Perfluorosulfonated Acid Membrane Induced by Fuel-Cell Operation, J. Appl. Polym. Sci., 117 (2010) 2121.
[24] L. Dubau, F. Maillard, M. Chatenet, J. André, E. Rossinot, Nanoscale compositional changes and modification of the surface reactivity of Pt3Co/C nanoparticles during proton-exchange membrane fuel cell operation, Electrochim. Acta, 56 (2010) 776.
[25] L. Dubau, F. Maillard, M. Chatenet, L. Guetaz, J. Andre, E. Rossinot, Durability of Pt3Co/C Cathodes in a 16 Cell PEMFC Stack: Macro/Microstructural Changes and Degradation Mechanisms, J. Electrochem. Soc., 157 (2010) B1887.
[26] G. De Moor, C. Bas, F. Lesage, A.S. Danerol, E. Claude, E. Rossinot, M. Paris, L. Flandin, N.D. Alberola, Understanding the Degradation of MEA in PEMFC: Definition of Structural Markers and Comparison Between Laboratory and On-Site Ageing, J. Appl. Polym. Sci., 120 (2011) 3501.
[27] L. Dubau, J. Durst, F. Maillard, L. Guétaz, M. Chatenet, J. André, E. Rossinot, Further insights into the durability of Pt3Co/C electrocatalysts: Formation of « hollow » Pt nanoparticles induced by the Kirkendall effect, Electrochim. Acta, 56 (2011) 10658.
[28] G. De Moor, C. Bas, N. Charvin, E. Moukheiber, F. Niepceron, N. Breilly, J. Andre, E. Rossinot, E. Claude, N.D. Alberola, L. Flandin, Understanding Membrane Failure in PEMFC: Comparison of Diagnostic Tools at Different Observation Scales, Fuel Cells, 12 (2012) 356.
[29] L. Dubau, J. Durst, F. Maillard, M. Chatenet, L. Guétaz, J. André, E. Rossinot, Heterogeneities of aging within a PEMFC MEA, Fuel Cells, 12 (2012) 188.
[30] L. Dubau, M. Lopez-Haro, L. Castanheira, J. Durst, M. Chatenet, P. Bayle-Guillemaud, L. Guétaz, N. Caqué, E. Rossinot, F. Maillard, Probing the structure, the composition and the ORR activity of Pt3Co/C nanocrystallites during a 3422h PEMFC ageing test, Appl. Catal. B: Environmental, 142-143 (2013) 801.
L’Encyclopédie de l’Energie est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article, merci de mentionner le nom de l’auteur, le titre de l’article et son URL sur le site de l’Encyclopédie de l’Energie.
Les articles de l’Encyclopédie de l’Energie sont mis à disposition selon les termes de la licence Creative Commons Attribution – Pas d’Utilisation Commerciale – Pas de Modification 4.0 International.






