La thermodynamique classique, par opposition à la thermodynamique statistique, reste essentielle à la compréhension des systèmes énergétiques. Il est donc indispensable d’en connaître les lois ainsi que l’invariant pour la deuxième loi, dénommé l’entropie.
Les lois qui gouvernent l’équivalence mécanique de la chaleur (première loi) et expriment la puissance motrice qui peut en être extraite (deuxième loi) ayant été expliquées (Lire : Thermodynamique, les lois), on peut aborder l’expression de ces lois dans un cadre qui en permet l’application et qui est cohérent avec celui de la mécanique, ce qui justifie le nom de thermodynamique.
L’effet mécanique, autrement dit le travail, était connu et mesuré de façon incontestable grâce aux développements de la physique depuis le 17ème siècle, bien avant le temps de Carnot. Il n’en était pas de même pour la chaleur et Carnot avait lui-même émis des doutes sur les connaissances de son époque : « Au reste, pour le dire en passant, les principaux fondements sur lesquels reposent la théorie de la chaleur auraient besoin de l’examen le plus attentif. Plusieurs faits d’expérience semblent à peu près inexplicables dans l’état actuel de cette théorie »[1]. Joule, Clausius, Thomson et Rankine ont, 20 ans après Carnot, refondé la théorie de la chaleur, la portant au niveau de qualité de la mécanique et élaborant ainsi la thermodynamique classique.
1. Chaleur et température : quelle mesure ?
La thermométrie, ou mesure de la température, est un préalable à toute théorie de la chaleur. Dans un article de quelques pages[2], Thomson en énonce ainsi le principe : « Le principe directeur pour la construction d’une échelle thermométrique semble évident à première vue : un thermomètre idéal devrait indiquer l’addition d’égales quantités de chaleur en regard d’égales élévations de température, mesurées suivant les divisions de l’échelle ». Or, note Thomson, ce principe est difficilement réalisé dans la pratique car la température est déduite de la dilatation de matériaux (solides, liquides ou gazeux) et ceux-ci ont des propriétés physiques variables de l’un à l’autre. De plus, pour un matériau donné, la dilatation varie avec sa température, le tout étant la cause de nombreuses imprécisions.
Les thermomètres sont calibrés sur l’échelle centigrade de Celsius (1701-1744) obtenue en divisant en 100 degrés égaux l’intervalle donné par l’instrument entre le point de fusion de la glace et le point de vaporisation de l’eau, à la pression atmosphérique. Mais la dilatation observée ne suit pas fidèlement la graduation régulière de l’échelle, elle n’est pas linéaire avec la température pour la plupart des matériaux utilisés dans les thermomètres.
L’état de l’art de l’époque montre que le thermomètre à air – utilisant la dilatation de l’air sous une pression constante – est le dispositif pratique le plus fiable et précis. En effet, la dilatation avec la température d’une masse donnée d’air à pression constante obéit à la loi de Gay-Lussac et Dalton : le volume croît proportionnellement à la température. Par ailleurs la contraction en fonction de la pression d’un gaz à température constante obéit à la loi de Boyle et Mariotte : le produit du volume et de la pression est constant. La synthèse des deux lois est la loi des gaz parfaits : le produit du volume et de la pression d’une masse donnée de gaz croît linéairement avec la température.
2. La loi des gaz parfaits
Emile Clapeyron a conçu une représentation graphique de cette loi, partant du principe que tout gaz (ou tout liquide, voire solide en général) est entièrement déterminé par la connaissance des trois grandeurs : pression P, volume V et température T[3].
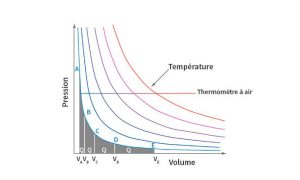
Déterminé par trois grandeurs, l’état d’un gaz peut être représenté dans un plan à la façon dont une carte géographique localise un lieu à partir de trois coordonnées : longitude, latitude et altitude. Le volume et la pression prennent la place de la longitude et de la latitude sur la carte ; la température est repérée par des courbes isothermes (reliant les points de même température) comme l’altitude l’est par les courbes de niveau. Dans ce diagramme de Clapeyron, le relief de la loi des gaz parfaits est représenté par les courbes isothermes ayant la forme d’hyperboles d’après la loi de Boyle et Mariotte : le produit des deux coordonnées de pression et de volume est constant. La Figure 1 en donne la représentation ; la température s’élève quand les courbes passent du bleu au rouge. Le thermomètre à gaz déduit la température du volume mesuré sur une droite horizontale à pression constante.
La loi des gaz parfaits était connue au début du 19ème siècle et avait été déterminée à partir d’expériences réalisées avec l’air, complétées d’expériences avec d’autres gaz ou vapeurs (d’eau en particulier). Suivant cette loi, Carnot a donné un calcul exact des quantités de chaleur absorbées ou relâchées pendant les transformations isothermes. Lors d’une détente, une quantité de chaleur est détruite, égale au travail produit par la détente (première loi). Pour que la détente reste isotherme, la quantité de chaleur détruite doit être remplacée par une égale quantité de chaleur absorbée par le gaz qui provient du corps isotherme à son contact. Si on connaît la quantité de travail produit, on connaît la quantité de chaleur absorbée. Or le travail, produit d’une force par le déplacement de son point d’application, est, pour un gaz, le produit de sa pression par la variation de son volume. Dans la Figure 1, l’aire grisée sous le parcours isotherme menant de A à E représente ce travail et donc la quantité de chaleur absorbée au contact du corps isotherme dans le cas d’une détente (ou, à l’inverse, dégagée dans le cas d’une compression).
Voyons à présent, le résultat établi par Carnot : « Lorsqu’un gaz varie de volume sans changer de température, les quantités de calorique absorbées ou dégagées par le gaz sont en progression arithmétique si les accroissements de volume sont en progression géométrique. » Cette proposition est illustrée par la progression des points de A à E : le point A ayant le volume VA, les volumes des points suivants B,C,D et E sont fixés suivant une progression géométrique de raison 2 où chacun est le double du précédent : 1, 2, 4, 8, 16 fois VA. Dans ces conditions, les quantités de chaleur absorbées par le gaz suivent une progression arithmétique et augmentent d’une unité à chaque doublement du volume : 1, 2, 3, 4 fois Q[4]. Ce qui peut également être exprimé par : la chaleur reçue par le gaz lors d’une détente isotherme varie suivant le logarithme du rapport des volumes.
3. Le travail de la machine réversible
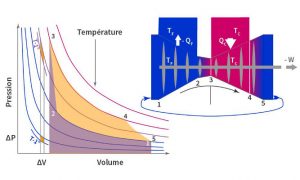
Le travail accompli au cours du cycle est représenté par Clapeyron comme indiqué dans la Figure 2. La suite des transformations composant le cycle sont : 1-2 compression isotherme, 2-3 compression adiabatique, 3-4 détente isotherme, 4-5 détente adiabatique. L’état 5 coïncide avec l’état 1, bouclant ainsi le cycle. Toutes les transformations sont réversibles : le sens de parcours peut être inversé et les grandeurs absorbées ou fournies par le gaz sont alors égales et opposées. Le travail dissipé lors de la compression du gaz de 1 à 3 est représenté par l’aire de couleur violette sous la courbe correspondante. Le travail produit par le gaz lors de sa détente l’est par l’aire sous la courbe joignant les points 3 à 5 (ou 1). Le travail produit par la détente est plus élevé en valeur absolue que le travail dissipé lors de la compression si bien que le bilan du cycle est un solde positif de travail décrit par l’aire dorée délimitée par le cycle.
On peut montrer que, dans ce cycle, le rapport des volumes lors de la détente (3-4) est l’inverse de celui de la compression (1-2) ; ainsi le travail produit par le cycle est proportionnel au logarithme de ce rapport de volume, comme l’est la chaleur échangée, ainsi que nous l’avons vu précédemment. Le travail produit dépend aussi de l’écart de température entre corps chaud et froid et il peut donc être résumé par l’équation : W = f(TC-TF). log (V1/V2). La fonction de l’écart de température a été calculée par Carnot puis par Clapeyron à l’aide de la loi des gaz parfaits. Toutefois, la vérification expérimentale était alors très incertaine et ne sera accomplie que plus tard par Regnault, comme précisé plus loin.
D’après le principe de la réversibilité, le cycle inverse de la Figure 2 dissipe une quantité de travail égale à cette aire dorée et transporte de la chaleur du corps froid au corps chaud. C’est ce que fait le système d’un réfrigérateur ou d’une pompe à chaleur utilisée pour le chauffage ou la climatisation.
4. L’invention de l’échelle thermodynamique
Ce retour sur la machine réversible utilisé par Carnot pour l’élaboration de sa théorie ne nous a pas écartés de la question de l’échelle de température posée. Thomson montre qu’elle apporte ce qu’il faut pour construire une échelle absolue de température : « Y a-t-il un principe qui puisse fonder une échelle thermométrique absolue ? Il m’apparaît que la théorie de Carnot sur la puissance motrice de la chaleur nous permet d’y répondre affirmativement ». C’est l’idée centrale de l’article de Thomson – Lord Kelvin – déjà cité, en cohérence avec le titre qui peut se traduire ainsi : « D’une échelle thermométrique fondée sur la théorie de Carnot de la Puissance Motrice de la Chaleur et calculée à partir des observations de Regnault. » Les résultats d’Henri Victor Regnault sont issus d’expériences très précises sur les gaz et vapeur utilisables pour la thermométrie ; ils montrent un accord très précis avec la loi des gaz parfaits.
Cette loi étant ainsi validée expérimentalement avec une grande précision, Thomson la reprend, complétée de mesures de propriétés physiques dues à Regnault pour calculer le travail réalisé lors d’un cycle fonctionnant sur un écart de température de 1° C. La Figure 2 illustre avec les deux petits losanges de couleur orange situés dans l’intervalle ∆V les travaux obtenus pour deux cycles travaillant sur un écart de 1°C à deux niveaux de la température chaude du cycle. La quantité de travail produite est la même pour les deux cycles. Les quantités de chaleur absorbées à partir du corps chaud sont déterminées par les surfaces comprises entre les deux traits verticaux séparés de ∆V, la portion d’isotherme la plus haute de chaque cycle et l’axe horizontal. On voit que la quantité de chaleur absorbée diminue quand on descend dans l’échelle de température, alors que le travail produit est le même. Aussi suivant Carnot, « la chute de calorique produit plus de puissance motrice dans les degrés inférieurs que dans les degrés supérieurs ». Cette phrase montre que pour Carnot, la chaleur se comporte comme une substance, justifiant son analogie avec l’eau. Toutefois, il indique ici une différence importante car une chute d’eau produit la même puissance motrice quelle que soit son altitude.
Thomson a en vue de construire une échelle absolue de température basée sur un cycle élémentaire de Carnot. Dans cette échelle, le degré serait tel qu’une machine réversible fonctionnant sur ce degré produirait, sur toute la hauteur de l’échelle, la même quantité de travail pour une unité de chaleur absorbée. Avec cette donnée du degré et un seul point repère, le point triple de l’eau[5], l’échelle peut être construite vers les deux infinis, chaud et froid, ce qui justifie son nom d’échelle absolue. Dans cette échelle absolue, le degré Celsius varie suivant la hauteur dans l’échelle : il se dilate en descendant dans l’échelle absolue. Comme le note Thomson: « C’est à quoi on pouvait s’attendre, quand on réfléchit que l’infiniment froid doit correspondre à un nombre fini de degrés en dessous du zéro de l’échelle [Celsius]. » Quand on approche de ce nombre fini de degrés, – 273°C, « le volume de l’air est réduit à rien (…) ; et ainsi -273° C de l’échelle Celsius est un point qui ne peut être atteint ».
Le système international a repris beaucoup de la philosophie de Thomson dans l’élaboration de son échelle internationale de température. Il a d’ailleurs donné le nom de kelvin (K), en son honneur (Lord Kelvin) au degré et à l’échelle internationale de température thermodynamique qui démarre par un zéro situé à l’infini inaccessible, et dans laquelle le point triple de l’eau est situé à 273,16 K. Il garde une relation simple entre l’échelle Celsius : t /°C = T /K – 273,15.
Dans l’échelle thermodynamique, la loi des gaz parfaits s’écrit : P.V = n.R.T où R est la constante universelle des gaz parfaits, n est le nombre de môles du gaz (qui fixe la masse du gaz pour un corps pur ou un mélange donné) et T la température thermodynamique en degrés kelvin[6]. De même, la quantité de chaleur, absorbée lors d’une détente isotherme (ou relâchée lors d’une compression) à température T, peut s’écrire simplement[7] : Q = – n*. R.T.
5. L’analogie avec la chute d’eau
C’est l’analogie avec une chute d’eau qui a guidé Carnot dans l’élaboration de sa théorie et qui garde toute sa valeur pour faire comprendre les concepts de la thermodynamique à condition de l’utiliser avec précaution. « On peut comparer avec assez de justesse la puissance motrice de la chaleur à celle d’une chute d’eau. Toutes deux ont un maximum qu’on ne peut dépasser (…). La puissance motrice d’une chute d’eau dépend de sa hauteur et de la quantité de liquide ; la puissance motrice de la chaleur dépend aussi de la quantité de calorique employé et de ce qu’on pourrait nommer, de ce que nous appellerons en effet la hauteur de chute. »[8] L’intérêt de cette analogie est confirmé par Thomson qui résume ainsi le travail de Carnot : « Carnot, partant de principes universellement reconnus démontre que c’est la descente graduelle (pour être réversible) de chaleur d’un corps chaud à un corps froid qui produit un travail mécanique par le moyen d’un moteur ; et il prouve que, réciproquement, la même quantité de chaleur peut être élevée du corps froid au corps chaud en dépensant cette même quantité de travail, la machine fonctionnant alors en sens inverse. De même qu’un travail peut être obtenu par la descente d’eau s’écoulant dans une turbine ; et en utilisant le travail produit, l’eau peut être remontée par une pompe »[9].
Le concept d’énergie aide à faire le lien entre les deux termes de l’analogie. L’énergie a été définie par William Rankine ainsi : « le terme d’énergie est utilisé pour comprendre tout attribut de la matière constituant la puissance de produire un changement contre une résistance [un travail] (…) Ceci inclut le mouvement et la puissance mécanique, l’action chimique, celle de la lumière, de l’électricité, du magnétisme et de toutes les formes de puissance connues ou inconnues, qui sont convertibles ou commensurables avec elles »[10] .
Rankine distingue l’énergie actuelle, cause d’un changement d’état de la matière et l’énergie potentielle « qui est mesurée par la quantité de changement de l’état de la substance et par le travail de la force exercée lorsque le changement est produit ». Enfin il reformule ainsi la première loi de la thermodynamique : « la loi de conservation de l’énergie, déjà connue, stipule que la somme des énergies actuelles et potentielles dans l’univers ne change pas. »
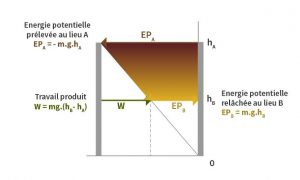
La partie hydraulique de l’analogie est représentée dans la Figure 3 : une masse d’eau chute graduellement (pour que le fonctionnement puisse être réversible) à partir du lieu A d’altitude hA.
À cette altitude, une masse d’eau de m kg possède une énergie potentielle m.g.hA. Quand cette masse d’eau entre dans la conduite forcée, c’est autant d’énergie potentielle que perd la retenue du barrage. Après être descendue dans la conduite forcée et avoir entraîné la turbine, la masse d’eau m est relâchée dans la rivière au lieu B et apporte là une énergie potentielle m.g.hB. L’installation capte au mieux la différence entre l’énergie potentielle puisée en A et celle restituée en B ; soit la longueur du segment W. Dans une machine réversible et sans perte dont l’économie est parfaite, l’énergie captée est intégralement transformée en travail. Dans toute machine réelle, des pertes dissiperont une partie du travail, environ 10% dans les centrales hydroélectriques (Lire : Hydraulélectricité : les conduites forcées de l’entreprise Bouchayer-Viallet à Grenoble).
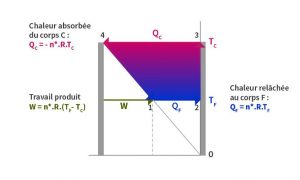
La Figure 4 présente le fonctionnement d’un moteur thermique pour n môles de gaz qui parcourent un cycle de Carnot défini aussi par le rapport des volumes de la détente isotherme. Dans ces conditions idéales, le gaz absorbe lors de sa détente (3-4) la quantité de chaleur QC = – nD*.R.TC du corps chaud de température TC (en degrés K). Après la détente adiabatique baissant sa température à TF, il relâche au corps froid TF la quantité de chaleur QF= nD*.R.TB. Le travail maximal qui peut être produit, W, est le solde des deux.
Ainsi, il y a une analogie entre le travail qui peut être extrait de la turbine hydraulique et le travail extrait d’une machine thermique lorsqu’on met en correspondance les grandeurs suivantes :
- énergie potentielle de l’eau prélevée à l’altitude du lieu A et chaleur absorbée du corps C lors de la détente isotherme ;
- énergie potentielle de l’eau relâchée à l’altitude de B et chaleur relâchée vers F lors de la compression isotherme.
La loi de Carnot est une loi aussi absolue que la loi de la gravitation. La chaleur ne peut pas passer spontanément d’un corps froid à un corps chaud pas plus que l’eau ne peut remonter spontanément une pente. Une machine qui utilise la chaleur ne peut pas produire plus de travail que celui permis par la loi de Carnot.
Une différence notable mérite toutefois d’être signalée sur la part de l’énergie rendue au milieu extérieur sans avoir été transformée en travail. Si rien n’empêche d’équiper une rivière puis un fleuve jusqu’à l’altitude zéro, au débouché dans l’océan, rien de tel pour la chaleur car la température ambiante, environ 283 K (10°C), est loin du zéro de l’échelle de température thermodynamique.
6. L’entropie
Le nom d’entropie est tiré du mot grec ancien qui indique le retour en arrière. Il a été introduit par Clausius pour désigner la grandeur qui se conserve dans le cycle réversible de Carnot[11]. Clausius a développé une formulation mathématique de la thermodynamique analogue à celle de la mécanique analytique (Laplace, Lagrange et Hamilton). Bien que nécessaires pour la rigueur des résultats, ces développements mathématiques ardus n’aident pas à communiquer le sens physique des phénomènes. Les références à Carnot et Thomson ont été nombreuses dans ce qui précède car ils abordent les concepts en faisant appel au sens physique et avec un formalisme mathématique limité au strict nécessaire (Lire : Energy consumption and entropy release in the biosphere).
Mais il faut mentionner l’entropie, concept qu’a introduit Clausius pour donner une autre formulation de la loi de Carnot. Clausius a recherché les invariants des transformations thermodynamiques, un invariant étant une grandeur, expression, relation ou propriété « qui se conserve dans une transformation de nature physique ou mathématique »[12].
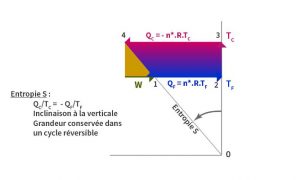
L’énergie est un tel invariant car elle se conserve suivant la première loi de la thermodynamique. Existe-t-il un invariant pour la deuxième loi ? Clausius le trouve dans le cycle réversible conçu par Carnot : c’est l’entropie. La Figure 5, analogue aux deux précédentes, montre que l’entropie est l’inclinaison de la droite allant de l’origine des axes au point 4 situé à la fin de la détente isotherme et de l’absorption d’énergie du corps chaud. Les triangles O21 et 034 sont semblables, le rapport entre leurs côtés droits est invariant et est égal à : -QC/TC = QF/TF. Ce rapport constant est l’entropie, l’invariant du cycle réversible de Carnot. Dans ce graphique, une droite partant de l’origine est une isentropique.
La proposition de Thomson d’une échelle absolue de température a une relation avec l’entropie. « La propriété caractéristique de l’échelle que je propose est d’avoir la même valeur pour tous les degrés ; ainsi l’unité de chaleur descendant d’un corps A à la température T sur cette échelle vers un corps B à la température T-1° donnerait le même effet mécanique quelle que soit la valeur de T. Celle-ci pourrait être à juste titre appelée une échelle absolue car sa propriété est d’être indépendante de toute substance. »
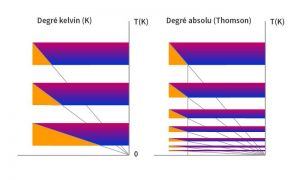
La Figure 6 donne une représentation comparative du degré dans l’échelle thermodynamique SI et dans cette échelle absolue. Dans les deux cas, l’axe vertical est l’échelle kelvin et les figures se situent près du zéro absolu. À gauche, les hauteurs des échelons correspondent au degré kelvin, égal au degré Celsius. À mesure qu’on se rapproche du zéro, la part du travail produit augmente.
Pour avoir « un même effet mécanique quelle que soit la valeur de T », il faut comme sur le schéma de droite, fixer un rapport constant du travail produit à la chaleur absorbée du corps chaud. Ce rapport constant est donné par la ligne verticale descendue de l’échelon le plus élevé. La hauteur des échelons inférieurs est alors déterminée par l’intersection de cette verticale avec l’isentropique du cycle correspondant. La hauteur des échelons s’amenuise à mesure qu’ils se rapprochent du zéro de l’échelle kelvin, montrant bien que c’est un infiniment froid inaccessible qui se situe au zéro de cette échelle. En effet pour l’atteindre, il faudrait exercer un travail infini.
La thermodynamique classique s’adresse aux phénomènes macroscopiques se produisant à l’échelle humaine. Une autre thermodynamique à l’échelle des molécules, naîtra ensuite. Elle donne un autre point de vue sur les grandeurs physiques, pression, température et chaleur, en tant qu’effet des collisions des molécules en mouvement dans les gaz et les liquides. Au vu des grands nombres mis en jeu (près d’un milliard de milliards de molécules dans un cube d’air d’un millimètre), une approche par la probabilité et la statistique des évènements est alors la seule possible, d’où le nom de thermodynamique statistique. Les concepts et les méthodes sont différents de ceux exposés ci-dessus ; ils éclairent les lois de la matière à ces échelles aboutissant à des théories pour les propriétés physiques, (chaleur spécifique, conductivité,…) qui recoupent les données de l’expérience. Mais cette thermodynamique statistique ne remplace pas la thermodynamique classique.
Pour faire un parallèle, même si les mécaniques quantiques ou relativistes sont venues après la mécanique classique, c’est la mécanique classique qui continue d’expliquer et prédire le vol des avions ou la trajectoire des sondes spatiales. Il en est de même en thermodynamique : la thermodynamique classique reste essentielle à la compréhension et à la maîtrise des systèmes énergétiques.
Notes et références
[1] Carnot S. (1824). Réflexions sur la puissance motrice du feu. Paris : Bachelier libraire, p. 37, note de bas de page.
[2] Thomson W. (Lord Kelvin)(1848). On an absolute thermometric scale founded on Carnot’ theory of the Motive Power of Heat and calculated from Regnault’s observations, Philosophical Magazine October. La note de bas de page 1 donne la référence du livre de Carnot, et indique que Thomson ne le connaît qu’à travers l’article de Clapeyron (note suivante) qui avait été traduit par Taylor.
[3] Clapeyron E.(1834). Mémoire sur la Puissance motrice de la chaleur. Journal de l’Ecole Polytechnique, Vol 23, p. 153-190.
[4] C’est une propriété de l’hyperbole qui a été établie par G. De Saint Vincent en 1647, en cherchant la quadrature de l’hyperbole par rapport à ses asymptotes.
[5] Point triple de l’eau : point d’équilibre thermodynamique où l’eau coexiste sous forme solide, liquide et vapeur. Ce point est situé à 0,01 °C au-dessus de la température de fusion de la glace à pression ambiante.
[6] Dans l’échelle Celsius courante, la loi des Gaz Parfaits s’écrit P.V = n.R.(t + 273,15).
[7] n*= n. Log (V2 / V1), où le nombre de moles n est multiplié par le logarithme du rapport des valeurs V2 et V1 du volume en fin et début de détente (ou de compression).
[8] Carnot S. (1824). Réflexions, op. cit, p. 28.
[9] Thomson W. On an absolute, op. cit.
[10] Rankine W. (1853). On the general law of transformation of energy. Phil. Magazine, S4, Vol. 5, p. 106. Traduction de l’auteur.
[11] Clausius R. (1879). The mechanical theory of heat. London : McMillan & Co.
[12] Le Petit Robert, édition 2004, p. 1399.
L’Encyclopédie de l’Énergie est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article, merci de mentionner le nom de l’auteur, le titre de l’article et son URL sur le site de l’Encyclopédie de l’Énergie.
Les articles de l’Encyclopédie de l’Énergie sont mis à disposition selon les termes de la licence Creative Commons Attribution – Pas d’Utilisation Commerciale – Pas de Modification 4.0 International.