Impossible de comprendre les phénomènes « réels », de la machine à vapeur au trou noir ou à l’univers primordial, sans connaître le développement conceptuel, pratique et théorique de la thermodynamique. Quelles en ont été les principales étapes ? Comment les physiciens les ont-ils franchies depuis le 18ème siècle ?
La thermodynamique est une branche de la science qui a souvent une image négative auprès des étudiants : les physiciens la trouvent souvent trop proche soit d’une science de l’ingénieur, soit de la chimie ; les chimistes la trouvent trop physique ; les ingénieurs trop vieillotte. Elle a la réputation, non méritée, d’être une science pleine d’approximations et de « bricolages », alors que ses fondements sont tout à fait rigoureux.
Elle est pourtant fascinante à plusieurs égards. Bâtie à partir de l’étude des machines à vapeur, c’est la science qui a accompagné de plus près le développement de la société industrielle, laquelle a bouleversé nos modes de vie. La mécanique d’Isaac Newton, par opposition, n’a pas eu une traduction aussi rapide dans ses conséquences sur la vie quotidienne. Les apports de la mécanique quantique, indispensable au développement de l’informatique, sont arrivés plus tardivement dans une société parfois qualifiée de « post-industrielle ». Pourtant, les conditions d’apparition et les questions posées par la thermodynamique sont en résonance avec les problèmes les plus actuels du moment, celui du choix de nos sources d’énergie pour le futur.
Un autre aspect fascinant est la façon dont des questions très concrètes d’ingénieur, telle que le rendement des machines à feu, a ouvert des réflexions conduisant finalement à la compréhension fondamentale que ces questions provenaient in fine de la nature microscopique du monde, fait d’une multitude d’atomes. La thermodynamique est en effet essentiellement une statistique sur un grand nombre de particules, d’après l’intuition géniale de Ludwig Boltzmann. De ce fait, elle a conduit à la théorie très élaborée et très fondamentale de la physique statistique, qui est considéré comme un des piliers de notre compréhension du monde.
C’est également la seule théorie à introduire de manière radicale la notion de processus irréversible et à considérer une grandeur physique, l’entropie, qui ne peut que croitre dans l’Univers. De ce fait, elle est indispensable pour l’existence de l’histoire, et donc de nos vies, et elle pose des questions fondamentales sur la question du temps et de l’irréversibilité (Lire : Energy consumption and entropy release in the biosphere).
1. La naissance de la machine à vapeur dans l’Angleterre du 18ème siècle
La naissance de la thermodynamique est assez clairement datée au tournant du 18ème et du 19ème siècle, quand les physiciens se sont aperçus qu’ils n’avaient aucune théorie pour comprendre le principe des machines à vapeur qui avaient commencé à se répandre en Angleterre (figure 1).

Fig. 1. La machine à vapeur de James Watt en 1775. [Source : © Musée des Arts et Métiers – https://www.facebook.com/musee.des.arts.et.metiers/photos/a.207703177171/10153968870957172/]
Poussé par la nécessité, on commença à utiliser de plus en plus le charbon de terre, ce qui implique bien sûr de creuser des galeries souterraines. Ce faisant, on rencontre rapidement la nappe phréatique, ce qui contraint de pomper l’eau des galeries pour continuer à s’enfoncer dans le sol. Les pompes étaient au début à traction animale. Cependant, un inventeur français, Denis Papin, avait mis au point au 17ème siècle une « marmite » sous pression, utilisée d’abord comme autoclave, qu’il appelle « digesteur », car elle permet de cuire bien plus rapidement des aliments (c’est l’ancêtre de notre cocotte minute). Réfugié en Angleterre depuis 1675 pour échapper aux persécutions contre les protestants, anticipant la révocation de l’Édit de Nantes, Denis Papin travaille avec Robert Boyle sur les propriétés des gaz. Il se rend compte que la production de vapeur peut aussi agir comme une force motrice sur un piston.

Fig. 2. La marmite de Denis Papin. [Source : © Arts et Métiers, http://visite.artsetmetiers.free.fr/papin.html]
Denis Papin se déplace ensuite en Allemagne, et met au point pour le seigneur de Cassel une « machine à élever l’eau » pour alimenter en eau une fontaine. Il a eu connaissance à la même époque d’un système de pompe, déjà utilisé dans les premières mines de charbon, mis au point par Thomas Savery. Dans la machine de Savery, la vapeur produit dans une chaudière remplit un cylindre, qui est ensuite aspergé d’eau froide, ce qui provoque un vide qui aspire l’eau. Denis Papin comprend l’intérêt de la vapeur pour actionner des mécanismes et décrit différentes inventions, dont un bateau mû par une roue à aubes, qu’il aurait utilisé pour voyager en Allemagne. Cependant, les bateliers allemands, inquiets pour l’avenir de leur profession, détruisent son invention. Denis Papin se réfugie à Londres, tente de reprendre ses travaux scientifiques mais est rejeté par Isaac Newton, devenu la grande célébrité de l’époque, et meurt probablement en 1713 dans l’anonymat et la pauvreté.
Au même moment, un forgeron, Thomas Newcomen, qui était au courant des inventions de Thomas Savery et de Denis Papin, conçoit la première machine à vapeur industrielle, appelée machine de Newcomen, également utilisée pour pomper l’eau des mines. Dans cette machine, une chaudière remplit de vapeur un cylindre en poussant un piston vers le haut. Lorsque le piston est en position haute, on refroidit le cylindre à l’eau froide, ce qui fait redescendre le piston, et actionne une pompe. Cette machine qui ne fonctionne donc qu’avec la pression atmosphérique, est, pour cette raison, dite « machine atmosphérique ». Elle sera utilisée pendant des décennies dans les mines, malgré un fonctionnement aléatoire (figure 3).
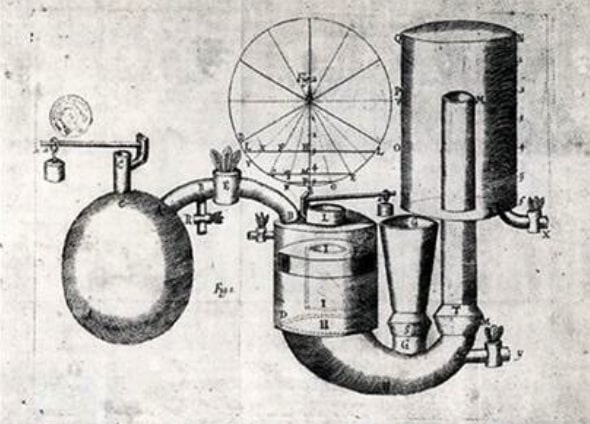
Fig. 3. La machine de Thomas Newcomen. [Source : © Histoire pour tous, https://www.histoire-pour-tous.fr/inventions/308-invention-machine-a-vapeur.html]
Avec toutes ces innovations, la machine de Watt, bien plus efficace que celle de Newcomen, se propage rapidement. On se rend compte qu’elle peut servir à entrainer de nombreux mécanismes : pressoir, moulins, métiers à tisser, entre autres. Ce sera le début de la révolution industrielle qui se répandra d’abord en Angleterre, puis dans le reste de l’Europe (Lire : Une brève histoire de l’énergie).
2. La technique questionne la science
Les améliorations successives posent un problème important aux scientifiques. En constatant qu’on peut fournir le même travail, extraire une certaine masse d’eau d’une certaine hauteur, par exemple, avec beaucoup moins de charbon, une question fondamentale se pose : jusqu’où peut-on améliorer ce rendement ? Quelle est la quantité minimale de charbon qu’il faut brûler pour élever par exemple de 10 pieds une livre d’eau ? Ce minimum, on s’en doute, n’est pas nul. On n’y parviendra pas avec un milligramme de charbon, mais quelle quantité faut-il alors ? A leur grande surprise, les physiciens tels Joseph-Louis Lagrange ou Pierre-Simon Laplace qui avaient déjà considérablement amélioré la mécanique de Newton par des travaux d’une grande finesse réalisent qu’ils n’ont aucune réponse à cette question. Pire, ils n’ont aucune idée de par où prendre ce problème (Lire : Qu’est-ce que l’énergie ?).
En fait c’est manifestement la chaleur qui produit le travail nécessaire, mais on ne connait pas encore la nature de la chaleur. La théorie la plus à la mode est celle du calorique, un fluide qui serait contenu dans les corps et se libérerait lors d’une combustion, en se propageant ensuite des corps chauds aux corps froids. Mais on ne sait pas comment calculer le travail que pourrait produire ce calorique …
Les grandes sociétés savantes offrent alors un prix à celui qui pourra le premier calculer le rendement des « machines à feu ». Et c’est un physicien français, Sadi Carnot, qui va apporter les premières réponses fondamentales à cette question, en posant les fondements de ce qui deviendra la thermodynamique.
3. La réponse de Sadi Carnot
Né en 1796, Sadi Carnot est le fils aîné du mathématicien et général Lazare Carnot, « l’organisateur de la victoire » des guerres révolutionnaires. Féru de poésie persane, il a donné à son fils un prénom tiré du nom du poète persan Saadi (سعدی). Après des brillantes études à Polytechnique, et malgré la disgrâce de sa famille suite à la défaite de Napoléon qui la poussa à s’exiler, il développe ses réflexions sur ce qu’il appellera dans son ouvrage fondamental la « puissance motrice du feu » (figure 4) (Lire : Sadi Carnot face à la fin de la civilisation thermo-industrielle).

Fig. 4. Nicolas Léonard Sadi Carnot. [Source : Louis-Léopold Boilly, Public domain, via Wikimedia Commons]
Par analogie avec l’eau, il comprend alors que le travail maximal sera obtenu si on évite les pertes du « fluide calorique » qui « fuiterait » s’il existe des parties de la machine à différentes températures. Il décrit alors une machine idéale exerçant ce qu’on appelle maintenant le « cycle de Carnot ».
L’autre notion absolument fondamentale introduite par Sadi Carnot est le concept d’une machine réversible. Il postule que certaines machines idéales pourraient fonctionner à l’envers, en étant capable de « remonter » la chaleur de la source froide à la source chaude, ce en consommant exactement le travail qu’elles auraient produit avec un fonctionnement normal.
Sadi Carnot note alors que l’impossibilité d’un travail monotherme implique que le rendement de toutes les machines réversibles, défini par le travail fourni par une certaine quantité de chaleur, doit être le même. En effet, si ce n’était pas le cas, il suffirait de faire fonctionner à l’envers la machine réversible de moins bon rendement, pour reprendre la chaleur donnée à la source froide, et de la coupler à une machine de meilleur rendement fonctionnant à l’endroit. La deuxième machine ayant un moins bon rendement, produit moins de travail, mais nécessite aussi moins de travail pour faire remonter la chaleur, donc en couplant les deux, on obtient un travail net sans avoir besoin de source froide, en contradiction avec le principe admis.
Le même raisonnement montre aussi que le rendement de toutes les machines réversibles doit être le même, et qu’une machine à vapeur idéale aura donc un rendement aussi bon que n’importe quelle autre machine.
Ces résultats fondamentaux seront cependant oubliés pendant un certain temps. Ils souffraient d’approximations conceptuelles qui laissaient quand même une incertitude sur la façon dont le travail était produit. Sadi Carnot était partisan de la théorie du calorique, il voyait l’écoulement de la chaleur comme une force mouvant la machine thermique, par analogie avec un cours d’eau, mais avec conservation du calorique. Il n’avait pas conscience de ce qu’on appelle désormais la conservation de l’énergie, et du fait que le travail provenait d’une transformation de la chaleur. Il semble cependant qu’il douta assez rapidement de la théorie du calorique, ce qui l’empêcha de publier pendant les huit années suivantes. Ses derniers écrits montrent qu’il a dû pressentir la transformation de chaleur en travail, et abandonner la théorie du calorique vers la fin de sa vie. Il mourra cependant précocement du choléra en 1832, à 36 ans, avant d’en donner une formulation satisfaisante. Nul doute qu’une vie plus longue lui aurait permis de faire bien plus avancer cette nouvelle science qu’il venait de fonder, la thermodynamique (Lire : Thermodynamique, les lois et Thermodynamique : énergie et entropie) C’est à de talentueux successeurs qu’il reviendra de le faire.
4. Les trois principes de la thermodynamique
L’idée de la conservation de l’énergie et de la transformation de chaleur en travail revint à un médecin et physicien allemand, Julius Robert Von Mayer qui a légué son nom à une relation thermodynamique entres capacités calorifiques, la « relation de Mayer » (figure 5).
En tant que médecin, il embarqua sur un bateau, le Java, en partance pour Batavia, l’actuelle Djakarta, capitale de l’Indonésie, appelée en ce temps Indes néerlandaises. Pendant ce voyage, il fit l’observation que les vagues pendant une tempête étaient plus chaudes qu’en temps calme, et que le sang veineux des blessés sous les tropiques était plus rouge que dans les régions froides. Il comprit que la température extérieure plus élevée diminuait le métabolisme car il y avait moins besoin de chauffer le corps. A son retour, il se consacre à ses réflexions sur la nature de la chaleur et émet l’hypothèse que la chaleur n’est qu’une forme d’énergie, ou plutôt, comme on disait à l’époque, de « force vive » ou « vis viva ». Peu reconnu de son vivant par ses contemporains qui lui reprochaient un statut peu académique et un langage parfois flou, ses idées seront développées et théorisées par James Prescott Joule, qui mesure l’équivalence entre chaleur et énergie mécanique , puis formalisées par William Thomson, futur Lord Kelvin, et Rudolf Clausius. Ces physiciens définiront rigoureusement la conservation de l’énergie totale, qui peut s’échanger soit sous forme de travail, soit sous forme de chaleur : c’est le premier principe de la thermodynamique.Clausius en particulier redécouvre les travaux de Sadi Carnot et en comprend l’importance. Il les diffuse largement auprès de ses contemporains, et formalise ses résultats en montrant en 1865 qu’ils peuvent être exprimés à l’aide d’une nouvelle fonction d’état thermodynamique, qu’il baptise l’entropie. La loi du rendement maximal de Carnot est en effet équivalente à dire qu’il existe une fonction entropie S, qui obéit aux règles suivantes :
- c’est une fonction d’état comme l’énergie, l’entropie d’un système reprend la même valeur si le système revient à son état initial ;
- sa variation, lorsqu’un système reçoit une chaleur Q de façon réversible, venant d’un réservoir à la température T, vaut Q/T (si l’échange de chaleur est réversible, la température du système doit aussi être égale à T) ;
- sa variation, lors d’un échange de chaleur irréversible, Q avec un réservoir à la température T est strictement supérieur à Q/T.
Il est facile de démontrer à partir de là que l’entropie totale d’un système et de son environnement ne peut jamais décroître. Elle est, au mieux, constante, si tous les échanges sont réversibles, et sinon ne peut que croître, s’ils sont irréversibles. Cette loi constitue le deuxième principe de la thermodynamique. On complète ces principes par un « troisième principe », qui dit que l’entropie d’un système est nulle au zéro absolu (principe de Nernst).
Ces principes s’avèrent absolument fondamentaux et vont s’appliquer à tous les processus physiques connus. Ils sont étendus aux lois de l’électricité, de la chimie, et même plus tard de la biologie. La thermodynamique quitte alors le statut de réflexion d’ingénieur faisant de la « physique appliquée » pour accéder au statut de théorie physique fondamentale, concernant tous les aspects du monde connu.
5. L’introduction de l’entropie
Elle est à l’origine d’un bouleversement dans les lois de la physique, qui, à vrai dire, était déjà présent dans la notion de machine irréversible de Carnot, ainsi que dans la loi de propagation de la chaleur découverte par Charles Fourier, et qui reviennent en réalité à décrire des processus augmentant l’entropie de l’Univers : elle introduit une asymétrie fondamentale dans le sens de l’écoulement du temps, une caractéristique qui est absente des lois de la mécanique de Newton, où toutes les équations sont réversibles. Un processus irréversible augmente l’entropie de l’Univers, et le processus inverse est donc impossible, puisqu’il conduirait à diminuer cette même entropie. Les physiciens du 19èmesiècle sont contraints d’admettre cette irréversibilité fondamentale, mais s’interrogent sur sa signification profonde. Comment des processus fondamentaux réversibles peuvent produire des phénomènes irréversibles ? La réponse sera donnée par un autre esprit brillant au destin tragique, Ludwig Boltzmann (figure 6).

Fig. 6. Ludwig et Henriette. [Source : © Mujeres con ciencia – Henriette y Ludwig los Boltzmann]
Cette intuition est absolument fondamentale et va fonder la version moderne de la thermodynamique, qu’on appelle la physique statistique. Elle permet de calculer explicitement les quantités macroscopiques observables en fonction des propriétés microscopiques de la matière. La thermodynamique est comprise comme étant en réalité une loi statistique sur les grands nombres, d’où son caractère absolument universel : bien au-delà des simples machines thermiques, les lois de la thermodynamique s’appliquent à tout le monde matériel, simplement parce qu’il est constitué d’un très grand nombre de particules.
Souffrant de bipolarité et soumis à des dépressions récurrentes, après plusieurs déconvenues professionnelles, Boltzmann finira par se suicider en se pendant dans sa chambre d’hôtel, en vacances, en 1906, sans laisser de mot d’explication. Sa célèbre formule sera gravée comme épitaphe sur sa tombe. Faisant l’objet de nombreuses critiques au départ, certains physiciens refusant l’hypothèse atomiste, sa théorie sera cependant rapidement confirmée par ses successeurs comme Albert Einstein (qui n’a pas que fondé la relativité mais a aussi fait considérablement progressé les idées atomistes, et particulier par l’étude du mouvement brownien), Jean Perrin ou Paul Langevin.
6. Le développement de la mécanique quantique
Il a permis de lever certaines ambiguïtés de la physique statistique classique. Par exemple, dans une vision atomiste « classique », le nombre de positions et de vitesses possibles est en réalité infini. La formule de Boltzmann n’est donc pas réellement applicable, à moins de supposer une « volume élémentaire » dans l’espace des phases, à l’intérieur duquel on considère les positions et vitesses indiscernables. Mais il n’y a aucune raison de considérer un volume élémentaire particulier en mécanique classique. Avec elle, cependant, du fait des relations d’incertitude de Werner Heisenberg, c’est la constante de Max Planck, h, qui permet de quantifier ce « volume élémentaire », égal à h3 (figure 7).

Fig. 7. Max Plank, pionnier de la physique quantique. [Source : © Blog Syti]
7. Des controverses à la théorie des « structures dissipatives »
Dès son apparition, la thermodynamique a soulevé de vives controverses. Comme souvent en science, chaque idée nouvelle a rencontré la résistance des scientifiques de la génération précédente, habitués à leurs concepts et leurs modèles. Une des discussions les plus vives a été sans doute celle concernant le monde vivant, qui semblait échapper aux lois de la croissance de l’entropie, comprises comme une augmentation générale du désordre. Au contraire, les êtres vivants semblent échapper à ce principe, puisqu’ils s’organisent spontanément en croissant dans un milieu apparemment « désorganisé » : la croissance d’un arbre à partir de terre, d’eau et de Soleil semble contradictoire avec l’augmentation de désordre impliquée par le second principe ! (Lire : Photosynthèse et biomasse).
De même le paradoxe du démon de Maxwell semble difficilement compréhensible : un démon capable de soulever opportunément une trappe microscopique entre deux récipients, en ne laissant passer que des particules ayant une grande vitesse dans un sens et des particules de petite vitesse dans l’autre sens, produirait à la longue une différence de température entre les deux récipients initialement à la même température. Il est facile de vérifier que ce processus ferait diminuer l’entropie totale de l’Univers, en contradiction avec le second principe.
En réalité une analyse plus fine montre qu’il n’y a pas de contradiction. Les êtres vivants ne s’organisent et ne diminuent localement l’entropie que grâce à une production d’entropie bien supérieure dans leur environnement. L’essentiel de la production d’entropie est en fait due à l’absorption des photons solaires par la Terre (le processus essentiel de la photosynthèse, qui sera ensuite à la base de toute l’alimentation du vivant), qui sont in fine réémis dans l’espace sous forme de photons infrarouge. En passant d’un rayonnement à 6000 K à un rayonnement à 300 K, le processus multiplie le nombre de photons par 20 environ, ce qui augmente considérablement l’entropie de l’Univers, bien plus que la baisse d’entropie produite dans les êtres vivants. De même, Léon Brillouin a montré que le paradoxe du démon de Maxwell disparaissait si on prenait en compte le traitement de l’information par le démon, qui était aussi un processus physique produisant nécessairement de l’entropie. En résumé, une diminution locale d’entropie n’est possible qu’en la payant par une production d’entropie bien supérieure ailleurs (figure 8).
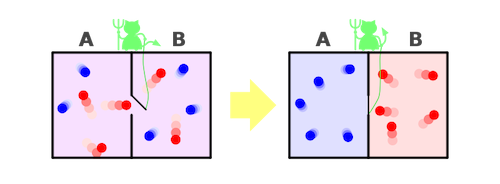
Fig. 8. Le démon de Maxwell. Source : User:Htkym, CC BY-SA 3.0, via Wikimedia Commons
Ces réflexions ont conduit au développement de théories des phénomènes irréversibles qui conduisent à l’organisation de structures appelées « structures dissipatives », qui apparaissent paradoxalement comme des structures organisées se formant spontanément dans un milieu produisant de l’entropie. Un exemple simple est celui des cellules de convection de Maurice Bernard, qui se produisent spontanément quand une couche de fluide est chauffée par sa base dans un champ de pesanteur. Ces systèmes et d’autres ont été étudiés par Ilya Prigogine et ses collaborateurs, qui ont montré que la production de structures organisées pouvait se faire spontanément à condition que la production d’entropie globale soit suffisante – et que ces structures conduisaient alors à minimiser cette production d’entropie, l’état d’équilibre étant un cas particulier où cette production est nulle.
La théorie de Prigogine éclaire d’un jour singulier la relation entre ordre et désordre. Si la production d’entropie signifie bien une marche vers le désordre global, elle s’accompagne de création d’ordre local et temporaire, assurant cette production d’entropie, et ne pouvant exister que grâce à elle. Ainsi la vie ne peut subsister que par la circulation continuelle de matière et d’énergie, entretenue essentiellement par le flux solaire. La civilisation humaine est dépendante de ces sources d’énergie, et l’extraordinaire complexification des sociétés modernes n’a été rendue possible que grâce à la croissance énorme de son flux d’entropie, essentiellement grâce à l’utilisation des réserves fossiles stockées depuis des centaines de millions d’années sous le sol, pétrole, gaz et charbon (Lire : La transition énergétique, enjeu majeur pour la planète).
Nous savons tous cependant que ces réserves s’épuisent, et que leur combustion produit des conséquences dommageables, enrichissant l’atmosphère en CO2 responsable d’un accroissement de l’effet de serre, et provoquant de nombreuses pollutions. Le défi qui attend l’humanité est énorme, puisqu’il s’agit de remplacer ces sources d’entropie destinées à disparaitre. En théorie, l’énergie solaire pourrait couvrir très largement nos besoins, même en amenant l’humanité entière à un niveau de vie occidental jugé confortable. Cependant, la dispersion spatiale et l’intermittence temporelle ont jusqu’à maintenant empêché de pouvoir l’utiliser à un niveau quantitativement équivalent à celui apporté par les fossiles. Jusqu’où pourrons-nous maintenir notre niveau de vie, ou devrons-nous revenir à une vie plus économe ? Ces questions très débattues actuellement sont évidemment cruciales, mais les réponses dépendent grandement de l’optimisme plus ou moins grand qu’on place dans nos capacités de développement technique (Lire : Politique énergétique et collectivités locales : le témoignage d’un élu).
En regardant en arrière, on ne peut qu’être frappé du développement conceptuel, pratique, et théorique de la thermodynamique. A partir de simples questions apparemment banales d’ingénieur, elle a permis d’acquérir une compréhension fondamentale de tous les phénomènes « réels », de comprendre les notions d’écoulement du temps et d’irréversibilité, qui n’étaient pas correctement décrits par la mécanique classique « réversible ». Elle s’applique aussi bien à une machine à vapeur qu’à un trou noir ou à l’univers primordial, et ses concepts sont indispensables pour tenter de maitriser les problèmes complexes qui vont se poser à l’humanité future. A ce titre, à coté de la relativité et de la mécanique quantique, elle a sa place dans les plus belles réalisations de l’esprit scientifique moderne.
Notes
Image de couverture. [Source : © La science pour tous – https://lasciencepourtous.cafe-sciences.org/articles/lathermodynamiquelesbases/]